18-03-2025 - Basi di chimica - La cinetica dei gas [EN]-[IT]

~~~ La versione in italiano inizia subito dopo la versione in inglese ~~~
ENGLISH
18-03-2025 - Chemistry Basics - Gas Kinetics [EN]-[IT]
With this post I would like to give a brief instruction about the topic mentioned in the subject
(code notes: X_74)
Gas Kinetics

Gas kinetics is that part of chemistry that studies the behavior of gas molecules.
The macroscopic properties of gases are explained by the kinetic-molecular model, a model that is the basis of gas kinetics.
The kinetic-molecular model studies the properties of gases such as pressure, temperature and volume and this study occurs through the movement and collisions of molecules.
The main points covered by gas kinetics are the following:
-Collision theory
-Activation energy
-Chemical kinetics
-Catalysis
-Gaseous reactions
An example of what can happen to a gas is the following.
An increase in the temperature of a rigid container containing nitrogen gas causes an increase in the pressure of the nitrogen because it increases the energy with which the molecules hit the walls of the container. This behavior is also codified by Gay-Lussac's law, which describes the direct relationship between pressure and temperature in a container at constant volume.
1st Law of Thermodynamics
The kinetics of gases is closely linked to the first law of thermodynamics because this principle concerns the energy balance of systems and the kinetics of gases is based precisely on energy in motion.
The 1st Law of Thermodynamics states that energy can neither be created nor destroyed, but only transformed from one form to another or transferred from one system to another. This principle is also known as the principle of conservation of energy
It is expressed as follows in mathematical terms:
ΔU = Q - L
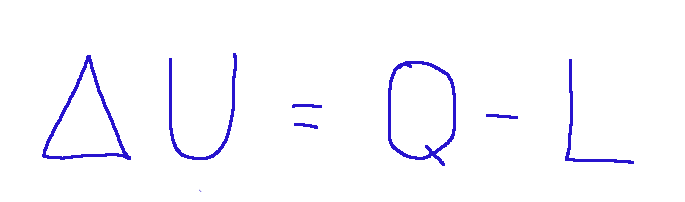
Where:
ΔU = change in the internal energy of the system
Q = heat exchanged. It is considered positive if absorbed by the system, negative if released.
L = work done by the system. It is considered positive if the system does work on the environment, negative if the work is done by the environment on the system.
Graham's law of diffusion of gases
Thomas Graham, in the 19th century, formulated a law that is now called Graham's Law.
This law states that the rate of diffusion or effusion of a gas is inversely proportional to the square root of its molar mass.
In mathematical terms it is expressed as follows:
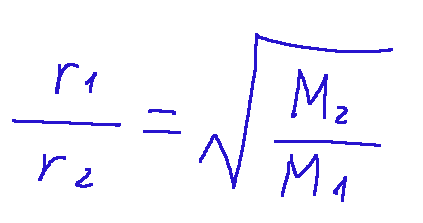
Where:
r1 and r2 = the rates of diffusion or effusion of the two gases
M1 and M2 = molar masses of the two gases.
Example
If we were to take hydrogen H2 with a molar mass of 2g/mol and oxygen O2 with a molar mass of 32 g/mol, with Graham's law we can immediately deduce that hydrogen (H2) will efflux or diffuse 4 times faster than oxygen.
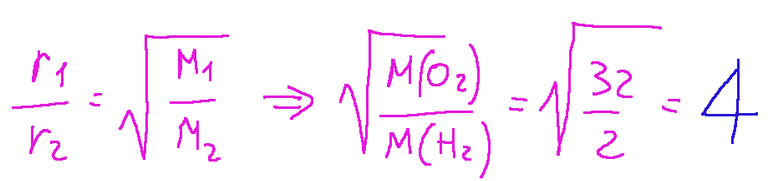
Dalton's Law
This law is mathematically expressed in the following way
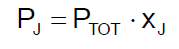
This expression means that in a mixture of ideal gases, the partial pressure of the j-th gas is equal to the product of the total pressure P by the mole fraction xJ.
Equivalent form of Dalton's law
The total pressure exerted by a mixture of ideal gases is equal to the sum of the partial pressures that would be exerted by the gases if they were present alone in an equal volume
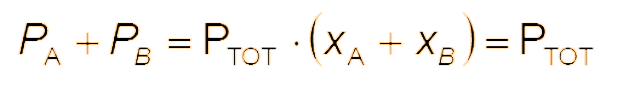
Density of an ideal gas
The density of a gas increases proportionally to the pressure and is inversely
proportional to the temperature.
Gases with different molar mass have different densities for the same T and P.
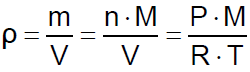
Where:
ρ = is the density of the gas.
m = is the total mass of the gas.
n = is the number of moles of the gas.
M = is the molar mass of the gas.
P = is the pressure.
V = is the volume.
R = is the gas constant.
T = is the temperature.
Basically, the formula described above describes the density of an ideal gas in relation to various properties of the gas such as mass, number of moles, pressure, temperature and the gas constant.
Conclusions
The study of gas kinetics is fundamental for various reasons, since it allows us to understand and predict the behavior of gases at the microscopic level (particle behavior) and macroscopic level (system behavior).
Question
Knowing gas kinematics is essential in many industrial fields.
Did you know that gas kinematics is fundamental in the design of internal combustion engines (cars, airplanes, industrial machines)?

[ITALIAN]
18-03-2025 - Basi di chimica - La cinetica dei gas [EN]-[IT]
Con questo post vorrei dare una breve istruzione a riguardo dell’argomento citato in oggetto
(code notes: X_74)
La cinetica dei gas

La cinetica dei gas è quella parte della chimica che studia il comportamento delle molecole di gas.
Le proprietà macroscopiche dei gas sono spiegate dal modello cinetico-molecolare, modello che è la base della cinetica dei gas.
Il modello cinetico-molecolare studia le proprietà dei gas come la pressione, la temperatura ed il volume e questo studio avviene tramite il movimento e le collisioni delle molecole.
I punti principali trattati dalla cinetica dei gas sono i seguenti:
-Teoria delle collisioni
-Energia di attivazione
-Cinetica chimica
-Catalisi
-Reazioni gassose
Un esempio di cosa può succedere ad un gas è il seguente.
Un aumento della temperatura di un recipiente rigido contenente azoto gassoso provoca un aumento della pressione dell’azoto in quanto aumenta l’energia con cui le molecole urtano le pareti del recipiente. Questo comportamento è codificato anche dalla legge di Gay-Lussac, che descrive la relazione diretta tra pressione e temperatura in un recipiente a volume costante.
1° Principio della Termodinamica
La cinetica dei gas è strettamente legato al primo principio della termodinamica in quanto questo principio riguarda il bilancio energetico dei sistemi e la cinetica dei gas è basata proprio sull'energia in movimento.
Il 1° Principio della Termodinamica afferma che l'energia non può essere né creata né distrutta, ma solo trasformata da una forma all'altra o trasferita da un sistema a un altro. Questo principio è conosciuto anche come il principio della conservazione dell'energia
Esso si esprime come segue in termini matematici:
ΔU = Q - L
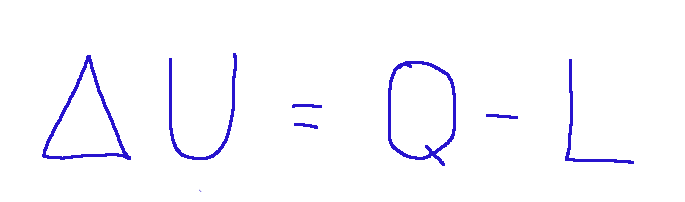
Dove:
ΔU = variazione dell'energia interna del sistema
Q = calore scambiato. Si considera positivo se assorbito dal sistema, negativo se ceduto.
L = lavoro compiuto dal sistema. Si considera positivo se il sistema compie lavoro sull'ambiente, negativo se il lavoro è fatto sull'ambiente sul sistema.
Legge di Graham sulla diffusione dei gas
Thomas Graham, nel XIX secolo, ha formulato una legge che oggi viene chiamata, Legge di Graham.
Questa legge dice che la velocità di diffusione o effusione di un gas è inversamente proporzionale alla radice quadrata della sua massa molare.
In termini matematici viene espressa nella seguente maniera:
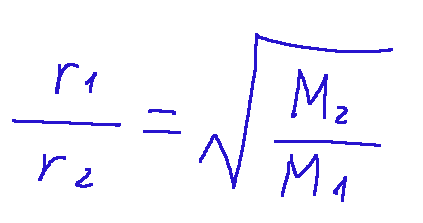
Dove:
r1 e r2 = le velocità di diffusione o effusione dei due gas
M1 e M2 = masse molari dei due gas.
Esempio
Se andassimo a prendere l'idrogeno H2 con massa molare di 2g/mol e l'ossigeno O2 con massa molare di 32 g/mol, con la legge di Graham possiamo dedurre immediatamente che l'idrogeno (H2) effluirà o diffonderà 4 volte più velocemente dell'ossigeno.
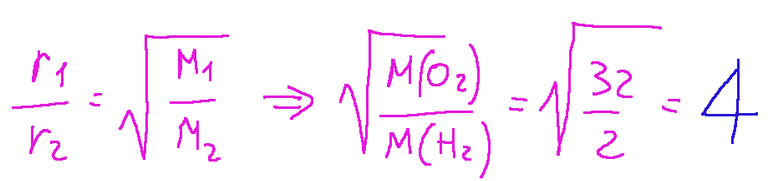
Legge di Dalton
Questa legge matematicamente è espressa nella seguente maniera
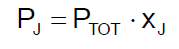
Questa espressione significa che in una miscela di gas ideali, la pressione parziale del gas j-esimo è pari al prodotto della pressione totale P per la frazione molare xJ.
Forma equivalente della legge di Dalton
La pressione totale esercitata da una miscela di gas ideali è uguale alla somma delle pressioni parziali che sarebbero esercitate dai gas se fossero presenti da soli in un eguale volume
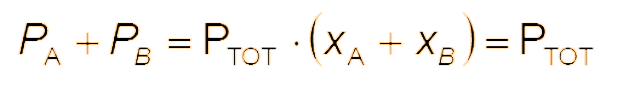
Densità di un gas ideale
La densità di un gas aumenta proporzionalmente alla pressione ed è inversamente
proporzionale alla temperatura.
Gas con massa molare diversa hanno diversa densità a parità di T e P.
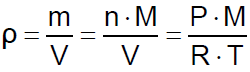
Dove:
ρ = è la densità del gas.
m = è la massa totale del gas.
n = è il numero di moli del gas.
M = è la massa molare del gas.
P = è la pressione.
V = è il volume.
R = è la costante dei gas.
T = è la temperatura.
Sostanzialmente la formula descritta qui sopra descrive la densità di un gas ideale in relazione a varie proprietà del gas come la massa, il numero di moli, la pressione, la temperatura e la costante dei gas.
Conclusioni
Lo studio della cinetica dei gas è fondamentale per vari motivi, poiché ci permette di comprendere e prevedere il comportamento dei gas a livello microscopico (comportamento delle particelle) e macroscopico (comportamento del sistema).
Domanda
Conoscere la cinetica dei gas è essenziale in molti ambiti industriali.
La sapevate che la cinematica dei gas è fondamentale nella progettazione dei motori a combustione interna (automobili, aerei, macchine industriali)?
THE END
When I studied petroleum engineering I saw a subject called gasotechnics, which explained the behavior of real gases, which is very different from that of ideal gases, there is for real gases a compressibility factor Z which was quite difficult to calculate.
Good post my friend, thanks for sharing.
Hi Carlos! Thanks for leaving a comment. The behavior and study of ideal gases is a mystery to me. When we enter the realm of the study of real gases I dissolve like a gas coming out of a container with the cap removed! I'm starting to have trouble understanding. I've also studied them, but I remember very little.
!discovery 30
This is a kind of topic that gives headache😅😅😅
Thanks for stopping by. Don't worry. We can summarize it all in the following concept. Gas kinetics is a theory that describes the microscopic behavior of the particles that make up a gas, explaining the macroscopic properties such as pressure, temperature and volume. Personally I think the main thing to understand is that gas particles are in constant motion and move randomly in all directions.
I have such intensive study of the gas many years ago. I barely remember anything. Thank you for sharing this key principle with the audience. I was nice to revisit this concept.
Peace
Thanks Oadissin for stopping by. I think it’s almost natural to understand that gas particles are in constant motion and move randomly in all directions. The other key thing in studying gas kinetics in my opinion is that the average kinetic energy of the particles is proportional to the absolute temperature (measured in Kelvin).
!PIZZA
🙏
This post was shared and voted inside the discord by the curators team of discovery-it
Join our Community and follow our Curation Trail
Discovery-it is also a Witness, vote for us here
Delegate to us for passive income. Check our 80% fee-back Program
@stefano.massari, you're rewarding 6 replies from this discussion thread.
I love the way you are able to explain this in a very simpler form
thanks for stopping by. In this article I try to argue a bit about gas kinetics. how molecules are disordered inside the gas. just as I write this comment it also occurred to me that I have not specified one of those things that in my opinion is important, namely the following. Collisions between gas molecules with the walls of a given container are elastic, that is, there is no loss of total kinetic energy.
$PIZZA slices delivered:
@oadissin(2/15) tipped @stefano.massari