15-03-2025 - Chemistry Basics - Oxidation number with exercises [EN]-[IT]

~~~ La versione in italiano inizia subito dopo la versione in inglese ~~~
ENGLISH
15-03-2025 - Chemistry Basics - Oxidation number with exercises [EN]-[IT]
With this post I would like to give a short instruction about the topic mentioned in the subject
(code notes: X_80)
Oxidation number with exercises
What is the oxidation number
The oxidation number in chemistry is a number that indicates the degree of oxidation of an atom in a molecule.
We can also say that this number represents the amount of electrons that an atom has gained, lost or shared compared to its neutral state.
In a chemical reaction, depending on how the electrons are transferred, we can have positive, negative or zero oxidation numbers.
For example, in water the oxidation number of hydrogen is +1, while that of oxygen is -2 and we can understand this better in the exercise below dedicated to water (H2O)
Exercise with water molecule
What is the oxidation number of oxygen in the water molecule?
In this case the procedure is quite simple.
So let's try to determine the oxidation number of oxygen (O) in the water molecule (H2O).
First, let's think about 3 points:
1-Hydrogen (H) usually has an oxidation number of +1 when it is bonded to non-metals. In this case we are bonded to oxygen, and oxygen is a non-metal.
2-We think of the oxidation number of oxygen as an unknown and identify it with an x
3-Remember that the water molecule is neutral, so the sum of the oxidation numbers must be 0
Below we write the equation:
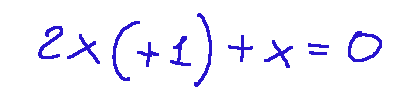
The equation is obtained in the following way.
Let's count the hydrogen atoms knowing that in the water molecule there are two hydrogen atoms

Let's assign the oxidation number of the hydrogen bonded to a non-metal, and in this case it is -1
since there are two hydrogen atoms the total contribution of the hydrogen will be
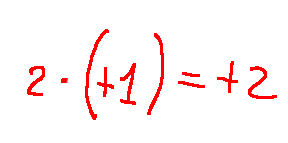
Developing the equation we will have that:

result
The oxidation number of oxygen in water (H2O) is -2
Exercise with the chlorine
What is the oxidation number of chlorine in the compound KClO₄?
First of all, we can learn from the data that potassium (K) has an oxidation number equal to +1.
Oxygen, and we have seen it before, has an oxidation number of -2
If we analyze the compound KClO₄ (potassium perchlorate) we can perform the following operations and arrive at the result.
Let's add the oxidation numbers:
(oxidation number of K) + (oxidation number of O) = 0 (zero because the compound is neutral)
Applying the substitution taking inspiration from the previous exercise we will therefore have:
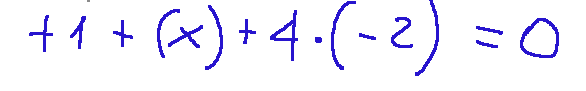
Below is the same formula where I have applied the various elements from which the oxidation numbers derive. oxidation
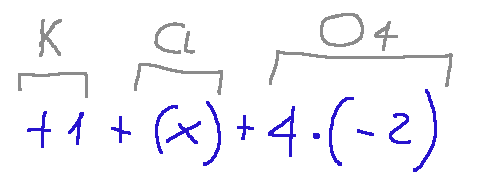
Conclusions
Knowing the oxidation number allows you to balance redox reactions and helps you understand the structure of the components. The discovery of oxidation numbers is a discovery that has formed slowly over time. However, we can say that Antoine Lavoisier introduced the idea of “oxidation” in the 18th century. That was the beginning of a theory that then developed in the years that followed.
Question
Do you remember studying oxidation numbers? Or do you remember doing exercises about oxidation numbers like the ones proposed in this post?

[ITALIAN]
15-03-2025 - Basi di chimica - Numero di ossidazione con esercizi [EN]-[IT]
Con questo post vorrei dare una breve istruzione a riguardo dell’argomento citato in oggetto
(code notes: X_80)
Numero di ossidazione con esercizi
Cosa è il numero di ossidazione
Il numero di ossidazione in chimica è un numero che indica il grado di ossidazione di un atomo in una molecola.
Possiamo anche dire che questo numero rappresenta la quantità di elettroni che un atomo ha guadagnato, perso o condiviso rispetto al suo stato neutro.
In una reazione chimica, a seconda di come vengono trasferiti gli elettroni, possiamo avere numeri di ossidazione positivi, negativi o pari a zero.
Ad esempio nell'acqua il numero di ossidazione dell'idrogeno è +1, mentre quello dell'ossigeno è -2 e questo lo possiamo capire meglio nell'esercizio qui sotto riportato dedicato proprio all'acqua (H2O)
Esercizio con molecola d'acqua
Quanto vale il numero di ossidazione dell'ossigeno nella molecola d'acqua?
In questo caso la procedura è abbastanza semplice.
Proviamo quindi a determinare il numero di ossidazione dell'ossigeno (O) nella molecola d'acqua (H2O).
Per prima cosa ragioniamo su 3 punti:
1-L'idrogeno (H) ha solitamente un numero di ossidazione pari a +1 quando è legato a non metalli. In questo caso siamo legato all'ossigeno, e l'ossigeno è un non metallo.
2-Il numero di ossidazione dell'ossigeno lo andiamo a pensare come un incognita e lo identifichiamo con una x
3-Ricordiamo che la molecola d'acqua è neutra, quindi la somma dei numeri di ossidazione deve dare 0
Qui di seguito scriviamo l'equazione:
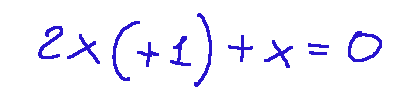
L'equazione di ricava nella seguente maniera.
Contiamo gli atomi di idrogeno sapendo che nella molecola d'acqua ci sono due atomi di idrogeno

Andiamo ad attribuire il numero di ossidazione dell'idrogeno legato ad un non-metallo, ed in questo caso è -1
visto che ci sono due atomi di idrogeno il contributo totale dell'idrogeno sarà
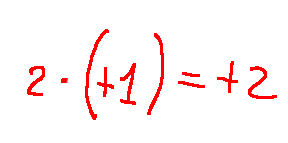
Sviluppando l'equazione avremo che:

risultato
Il numero di ossidazione dell'ossigeno nell'acqua (H2O) è -2
Esercizio con il cloro
Quanto vale il numero di ossidazione del cloro nel composto KClO₄?
Prima di tutto possiamo apprendere dai dati che il potassio (K) ha un numero di ossidazione uguale a +1.
L'ossigeno, e l'abbiamo visto anche prima, ha un numero di ossidazione di -2
Se andiamo ad analizzare il composto KClO₄ (perclorato di potassio) possiamo eseguire le seguenti operazioni ed arrivare al risultato.
Sommiamo i numeri di ossidazione:
(numero di ossidazione di K) + (numero di ossidazione di O) = 0 (zero perché il composto è neutro)
Applicando la sostituzione prendendo spunto dall'esercizio precedente avremo quindi:
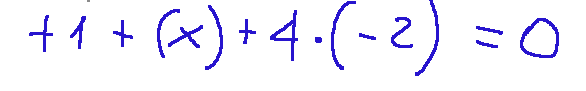
Qui di seguito la stessa formula dove ho applicato i vari elementi da cui derivano i numeri di ossidazione
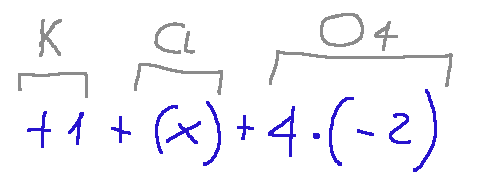
Conclusioni
Conoscere il numero di ossidazione permette di bilanciare le reazioni di ossidoriduzione e aiuta a capire la struttura dei componenti. La scoperta dei numeri di ossidazione è una scoperta che si è formata piano piano nel tempo. Possiamo però dire che Antoine Lavoisier introdusse l’idea di “ossidazione” nel XVIII secolo. Quello fu l'inizio di una teoria che poi si sviluppò negli anni a seguire.
Domanda
Ricordate di aver studiato i numeri di ossidazione? Oppure ricordate di aver fatto degli esercizi a riguardo dei numeri di ossidazione tipo quelli proposti in questo post?
THE END
!discovery 30
Grazie Liberty per il supporto! È ormai da tanto che eseguo questi post educativi, forse più di 1 anno. Adesso qualcuno ogni tanto lascia anche dei commenti interessanti. Da uno ho imparato che le reazioni di ossidoriduzione sono un processo usato anche nei pannelli fotovoltaici. L’ho imparato proprio da un commento di un utente HIVE. Io sono qui a ringraziarti perchè senza il tuo aiuto e sostegno, passare il primo anno sarebbe stato impossibile.
This post was shared and voted inside the discord by the curators team of discovery-it
Join our Community and follow our Curation Trail
Discovery-it is also a Witness, vote for us here
Delegate to us for passive income. Check our 80% fee-back Program
@stefano.massari, I paid out 0.135 HIVE and 0.031 HBD to reward 4 comments in this discussion thread.
I just understand now much more better about chemistry by reading your post today
Thanks for leaving a comment. What I would like to do in my next posts about chemistry, I would like to write conclusions that are understandable to everyone. In these conclusions I would like to insert the main and fundamental concepts of what I explain in that particular post, without describing technical details in the conclusions.
Mi ricordo di qualcosa, pensando che nel mio lavoro molta di questa conoscenza rimane indietro, è più una questione di osservazione.
Io penso che se ci sia una materia scientifica che potremmo avvicinare alla magia, sia proprio la chimica.
@tipu curate