14-03-2025 - Chemistry Basics - REDOX Reactions with Exercise [EN]-[IT]

~~~ La versione in italiano inizia subito dopo la versione in inglese ~~~
ENGLISH
14-03-2025 - Chemistry Basics - REDOX Reactions with Exercise [EN]-[IT]
With this post I would like to give a short instruction about the topic mentioned in the subject
(code notes: X_82)
REDOX Reactions with Exercise
Description
Redox reactions are a type of chemical reaction in which a transfer of electrons occurs between two chemical species (compounds).
Redox reactions are also known as oxidation-reduction reactions.
Let's try to explain this by analyzing one of the most well-known oxidation-reduction reactions, the reaction between zinc and copper (II) ions

From this reaction we can deduce that:
-Zinc (Zn) oxidizes (loses electrons) by losing two electrons to form zinc ions (Zn²⁺)
-Copper ions (Cu²⁺) are reduced, in fact they acquire two electrons to form metallic copper (Cu)
Where:
Oxidation = a chemical process in which a substance loses electrons.
Reduction = is the opposite of oxidation, i.e. the acquisition of electrons
Note: When iron (Fe) is transformed into iron oxide, i.e. Fe₂O₃, it simply happens that the iron loses electrons.
Balancing examples
Let's try to determine the grams of gold that dissolve in 200 mL of a 0.15 M KCN solution, according to the reaction (to be balanced):
Au + CN‒ + O2 + H2O → Au(CN)4‒ + OH‒
We report below the reaction written exactly according to the formal rules, previously described not with the correct spelling due to keyboard impediments.
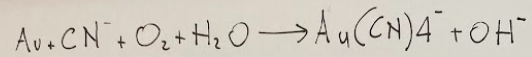
Where:
Molarity = measure of the concentration of a chemical solution. Molarity (M) is measured as Moles of solute / Volume of solution in liters
mol = abbreviation for mole. The mole is one of the fundamental units of chemistry. It represents a quantity of a substance. The mole is defined as the number of particles contained in 12 grams of carbon-12 which corresponds to Avogadro's number (I could write an entire article on this if you think it's necessary)
1 mol = 6.022 x 10^23 particles
Procedure
The first step to take is to balance the chemical reaction.
So given the chemical reaction
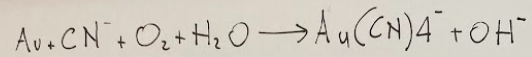
we calculate the moles of KCN (potassium cyanide) in the solution by looking for the molarity and the volume and doing the product between these two data, below the formula and the calculations.
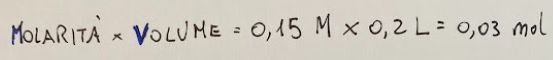
From this calculation we can deduce that 8 moles of CN⁻ (cyanide ion) react with 4 moles of Au (gold).
The molar ratio between CN⁻ and Au is double, that is 2:1.
Therefore the moles of Au that react are half, that is.
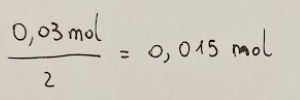
Knowing that the molar mass of Au is 197 g/mol. we can determine that the mass of gold (Au) that dissolves is obtained from the following formula.
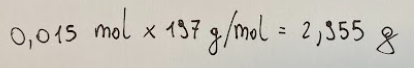
Conclusions
Redox reactions are fundamental for the processes of cellular metabolism, corrosion and battery current generation.
Question
Have you ever heard of Redox reactions? Did you know that Redox reactions are crucial processes in generating current in batteries?

[ITALIAN]
14-03-2025 - Basi di chimica - Reazioni REDOX con esercizio [EN]-[IT]
Con questo post vorrei dare una breve istruzione a riguardo dell’argomento citato in oggetto
(code notes: X_82)
Reazioni REDOX con esercizio
Descrizione
Le reazioni Redox sono un tipo di reazione chimica in cui avviene un trasferimento di elettroni tra due specie (composti) chimici.
Le reazioni Redox sono note anche con il nome di reazioni di ossidoriduzione.
Proviamo a spiegare la cosa analizzando una delle reazioni di ossidoriduzione più conosciute, la reazione tra zinco e ioni rame (II)

Da questa reazione possiamo dedurre che:
-Lo zinco (Zn) si ossida (perdere elettroni) perdendo due elettroni per formare ioni zinco (Zn²⁺)
-Gli ioni di rame (Cu²⁺) si riducono, questi infatti acquistano due elettroni per formare rame metallico (Cu)
Dove:
Ossidazione = un processo chimico in cui una sostanza perde elettroni.
Riduzione = è l'opposto dell'ossidazione, cioè l'acquisizione di elettroni
Nota: Quando il ferro (Fe) si trasforma in ossido di ferro, ovvero Fe₂O₃, avviene semplicemente che il ferro perde elettroni.
Esempi di bilanciamento
Proviamo a determinare i grammi di oro che si sciolgono in 200 mL di una soluzione 0.15 M di KCN, secondo la reazione (da bilanciare):
Au + CN‒ + O2 + H2O → Au(CN)4‒ + OH‒
Riportiamo qui di seguito la reazione scritta esattamente secondo le norme formali, prima descritta non con la grafia corretta a causa di impedimenti da tastiera.
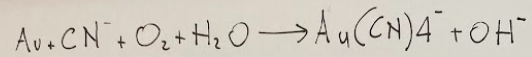
Dove:
Molarità = misura della concentrazione di una soluzione chimica. La molarità (M) si misura come Moli di soluto / Volume della soluzione in litri
mol = abbreviazione di mole. La mole è una delle unità fondamentali della chimica. Rappresenta una quantità di una sostanza. La mole è definita come il numero di particelle contenute in 12 grammi di carbonio-12 che corrisponde al numero di Avogadro (su questo potrei fare un articolo intere se lo ritenete necessario)
1 mol = 6,022 x 10^23 particelle
Svolgimento
Il primo passaggio da fare è bilanciare la reazione chimica.
Quindi data la reazione chimica
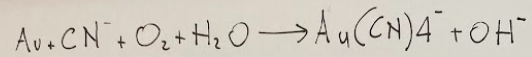
calcoliamo le moli di KCN (cianuro di potassio) nella soluzione cercando la molarità ed il volume e facendo il prodotto tra questi due dati, qui di seguito la formula ed i calcoli.
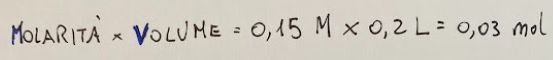
Da questo calcolo possiamo dedurre che 8 moli di CN⁻ (ione cianuro) reagiscono con 4 moli di Au (oro).
Il rapporto molare tra CN⁻ e Au è del doppio, cioè 2:1.
Pertanto le moli di Au che reagiscono sono la metà, ovvero.
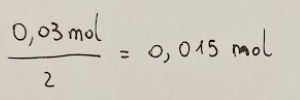
Sapendo che la massa molare di Au è 197 g/mol. possiamo determinare che la massa di oro (Au) che si scioglie si ricava dalla seguente formula.
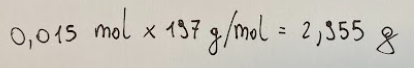
Conclusioni
Le reazioni Redox son fondamentali per i processi di metabolismo cellulare, corrosione e generazione di corrente delle batterie.
Domanda
Avete mai sentito parlare di reazioni Redox? Sapevate che le reazioni Redox sono processi cruciali nella generazione di corrente nelle batterie?
THE END
Generation of electricity with batteries first came to my mind when I read the title of the post. I think the redox process is also used in photovoltaic cells to convert sunlight to electricity. Thanks for the lesson.
Thanks for leaving this message and I admit I didn't know this! I did some research and read that redox reactions are also fundamental in photovoltaic systems. In solar cells based on sensitizing dyes and in fuel cells. Are you a chemist or a chemistry enthusiast?
Just an enthusiast. I like reading scientific stuff in my spare time. Especially in Physics, Mathematics and Chemistry. Thanks for your support.
Yes, Redox reaction is involved in generating current in batteries. This is because the reaction that transfers electrons is been oxidized while the current that gains electrons is been reduced.
Thanks for leaving a comment. I know that the battery was invented right here in Italy where I live. It was Alessandro Volta who in 1800 invented the battery and demonstrated that electricity could be produced chemically without necessarily using the friction of the electrostatic machines of the time. I don't remember if I've already asked you this question, are you a chemist or do you have a passion for chemistry?
Ho sentito parlare di questo argomento, lo vediamo anche nella corrosión dei metalli
Infatti le reazioni REDOX sono molto adatte a comprendere il vari trattamenti chimici da eseguire sui metalli. Si vede che lavori nel settore industriale
@stefano.massari, I paid out 0.299 HIVE and 0.000 HBD to reward 3 comments in this discussion thread.
This post was shared and voted inside the discord by the curators team of discovery-it
Join our Community and follow our Curation Trail
Discovery-it is also a Witness, vote for us here
Delegate to us for passive income. Check our 80% fee-back Program
!discovery 30
@tipu curate
Upvoted 👌 (Mana: 40/60) Liquid rewards.