06-07-2024 - Energy systems - Combustion [EN]-[IT]

~~~ La versione in italiano inizia subito dopo la versione in inglese ~~~
ENGLISH
ITALIAN
06-07-2024 - Energy systems - Combustion [EN]-[IT]
The combustion
Definition
Combustion is a chemical reaction. This reaction is called oxidation-reduction and is accompanied by an exothermic reaction, i.e. the development of heat.
Combustion is therefore a process that involves two elements:
-the fuel
-the oxidizer
The fuel contains chemical elements that are oxidized (carbon, hydrogen, sulfur)
The oxidizer constitutes the oxygen carrier that carries out the oxidation. We can state that atmospheric air is by far the most used oxidant.
Fuel classification
Fuels are classified into solid, liquid and gaseous, therefore based on their physical state. Below are some examples.
-solid fuels, for example coal, coke, biomass and wood;
-liquid fuels such as alcohol, crude oil, petrol and kerosene;
-gaseous fuels such as natural gas, LPG, biogas.
Main components of fuels
The main components of solid fuels are carbon C, hydrogen H, sulfur S, oxygen O, nitrogen N and ash. Furthermore, water is present, which significantly influences the amount of energy made available
The main components of liquid fuels are aliphatic hydrocarbons (paraffins) or cycloalkanes (naphthenes)
The main components of gaseous fuels are natural gas, synthesis gas (syngas), biogas or liquefied petroleum gas.
Stoichiometric mass
Stoichiometric mass is one of the main concepts of chemistry and thermodynamics when we talk about combustion reactions.
Basically it is the quantity of air required to complete the combustion of a given fuel.
Stoichiometric volume
Stoichiometric mass and stoichiometric volume are two similar concepts.
Stoichiometric volume refers to the amount of air needed to completely burn a given amount of fuel. This amount of air is expressed in terms of volume.
Excess air
Excess air in a combustion process refers to the amount of air more than is theoretically needed to completely burn a fuel. This process is useful for optimizing combustion efficiency and minimizing polluting emissions.
Recall that during the combustion of fuels, air is usually supplied in quantities slightly higher than the stoichiometric one.
The value of the excess air depends on the type of fuel. Proof of this is the fact that it is easier to have a good mix between fuel and oxidizer in gaseous fuels compared to liquid and solid ones.
The calorific value
The calorific value is the energy, per unit of mass, that must be subtracted from the products of a reaction to bring them to the initial temperature of the reactants, in the case of ideal combustion, i.e. without unburned substances.
In case of excess air, the calorific value remains unchanged, as its contribution is cancelled.
We can also define the calorific value as follows.
Heating value is a measure of the energy released during the complete combustion of a specific amount of fuel.
Higher and lower calorific value
There are 2 calorific value values:
the higher calorific value, usually accompanied by the acronym HHV
the lower calorific value, usually accompanied by the acronym LHV
considerations
The higher heating value (HHV) takes into account the latent heat released, while the lower heating value (LHV) does not take into account the latent heat, as the fumes are often released at temperatures higher than the condensation temperatures.
Below is the relationship between the two calorific values:
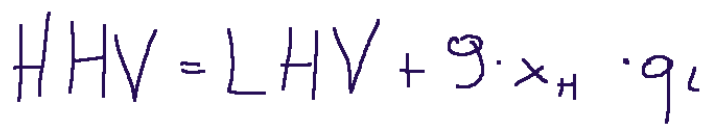
Conclusions
Combustion is a chemical reaction that produces heat. This process occurs between a fuel and an oxidizer and starts in the presence of sufficient heat to trigger the reaction.
Request
Have you ever studied combustion in your work or school?

ITALIAN
06-07-2024 - Sistemi energetici - La combustione [EN]-[IT]
La combustione
Definizione
La combustione è una reazione chimica. Questa reazione si chiama ossidoriduzione ed è accompagnata da una reazione esotermica, ovvero da uno sviluppo di calore.
La combustione è quindi un processo che coinvolge due elementi:
-il combustibile
-il comburente
Il combustibile contiene gli elementi chimici che vengono ossidati (carbonio, idrogeno, zolfo)
Il comburente costituisce il vettore dell’ossigeno che realizza l’ossidazione. Possiamo affermare che l’aria atmosferica è di gran lunga il comburente più utilizzato.
Classificazione dei combustibili
I combustibili vengono classificati in solidi, liquidi e gassosi, quindi in base allo stato fisico. Qui di seguito alcuni esempi.
-combustibili solidi, ad esempio carbone,Coke, biomassa e legna;
-combustibili liquidi ad esempio alcol, petrolio greggio, benzina e cherosene;
-combustibili gassosi ad esempio il gas naturale, GPL, biogas.
Principali componenti dei combustibili
I principali componenti dei combustibili solidi sono carbonio C, idrogeno H, zolfo S, ossigeno O, azoto N e ceneri . Inoltre è presente acqua, che influenza notevolmente la quantità di energia messa a disposizione
I principali componenti dei combustibili liquidi sono idrocarburi alifatici (paraffine) o cicloalcani (nafteni)
I principali componenti dei combustibili gassosi sono il gas naturale, gas di sintesi (syngas), biogas o gas di petrolio liquefatto.
Massa stechiometrica
La massa stechiometrica è uno dei concetti principali della chimica e della termodinamica quando parliamo delle reazioni di combustione.
Sostanzialmente essa è la quantità di aria richiesta per completare la combustione di un dato combustibile.
Volume stechiometrico
La massa stechiometrica ed il volume stechiometrico sono due concetti analoghi.
Il volume stechiometrico si riferisce alla quantità di aria necessaria per bruciare completamente una quantità data di combustibile. Questa quantità di aria è espressa in termini di volume.
Eccesso d’aria
L'eccesso d'aria in un processo di combustione si riferisce alla quantità di aria in più rispetto a quella teoricamente necessaria per bruciare completamente un combustibile. Questo processo è utile per ottimizzare l’efficienza della combustione e ridurre al minimo le emissioni inquinanti.
Ricordiamo che durante la combustione di combustibili, l'aria viene solitamente fornita in quantità leggermente superiore a quella stechiometrica.
Il valore dell’eccesso d’aria dipende dalla tipologia di combustibile. A prova di questo c’è il fatto che è più facile avere una buona miscelazione tra combustibile e comburente nei combustibili gassosi rispetto a quelli liquidi e a quelli solidi.
Il potere calorifico
Il potere calorifico è l’energia, per unità di massa, che bisogna sottrarre ai prodotti di una reazione per portarli alla temperatura iniziale dei reagenti, in caso di combustione ideale, ovvero senza incombusti.
In caso di eccesso d’aria il potere calorifico resta invariato, in quanto il suo contributo si annulla.
Possiamo definire il potere calorifico anche come segue.
Il potere calorifico è una misura dell'energia rilasciata durante la combustione completa di una specifica quantità di combustibile.
Potere calorifico superiore ed inferiore
I valori del potere calorifico sono 2:
il potere calorifico superiore, solitamente accompagnato dalla sigla HHV
il potere calorifico inferiore, solitamente accompagnato dalla sigla LHV
considerazioni
Il potere calorifico superiore (HHV) tiene conto del calore latente rilasciato, mentre il potere calorifico inferiore (LHV), non tiene conto del calore latente, in quanto spesso i fumi vengono rilasciati a temperature superiori rispetto a quelle di condensazione.
Qui di seguito la relazione tra i due poteri calorifici:
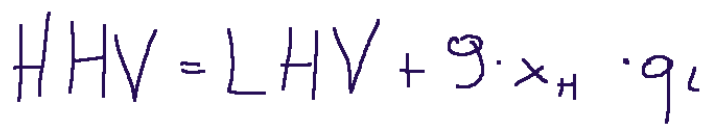
Conclusioni
La combustione è una reazione chimica che produce calore. Questo processo avviene tra un combustibile e un comburente e parte in presenza di calore sufficiente per innescare la reazione.
Domanda
Nel vostro lavoro o a scuola avete mai studiato delle combustioni?
THE END
What a pleasure to remind ourselves of those things we had forgotten. This lessons as made me remember that combustion is a chemical reaction which involves the release of heat
This physics lesson is intellectually stimulating and I grabbed a thing or two. First thing that came to mind while reading is systems in which combustion take place normally like gasoline engines. The info is a very practical one. Thanks for writing.
Oh wow
I have always thought that we could only regard crude oil as fuel
I never knew it consists of so many other things too
That’s awesome!
Combustion is a very interesting course
Thank you for the lecture
Understanding its chemical aspects and the diverse types of fuels opens up new perspectives which is pretty great man. I think I'm getting the hang of this.